Infection à Streptococcus pyogenes : l’apparition d’un mutant au rôle paradoxal
Streptococcus pyogenes, ou Streptocoque du Groupe A (SGA), un redoutable pathogène est responsable de plus de 517 000 décès par an dans le monde. Lors d’une infection expérimentale par SGA, un mutant apparait in vivo qui présente pourtant une virulence atténuée. Dans un article publié dans Nature communications, des scientifiques expliquent les raisons qui poussent à l’apparition paradoxale de ce mutant qui affecte le contenu membranaire, et les implications de cette découverte pour l’identification de nouvelles cibles thérapeutiques.
Le régulateur de la voie de biosynthèse des acides gras chez les streptocoques et son rôle dans l’infection
La membrane lipidique est centrale pour toutes transactions cellulaires. De nombreuses bactéries synthétisent des acides gras, précurseurs des lipides, composants essentiels des membranes, via la voie de synthèse appelée FASII. Chez le redoutable pathogène Streptococcus pyogenes, ou Streptocoque du Groupe A (SGA), responsable de plus de 517 000 décès par an dans le monde, l’expression des gènes de cette voie repose sur l’activité d’une protéine, appelée FabT qui va se fixer sur l’ADN et réprimer l’expression des gènes FASII. Les scientifiques se sont intéressés au rôle de FabT durant l’infection à SGA. Les scientifiques ont été intrigués par un paradoxe : bien que les défauts de FabT soient liés à une virulence atténuée dans les modèles animaux, des mutants spontanés de FabT apparaissent in vivo.
L’ambivalence entre FabT répresseur nécessaire à l’infection et émergence de mutants fabT.
FabT agit comme un répresseur de FASII ce qui se traduit par une incorporation d’acides gras exogènes (eAGs) en remplacement de leur synthèse. Les souches mutées pour FabT ont perdu le signal qui arrête la synthèse d’AG, même lorsque des eAGs sont disponibles. En conséquence, elles produisent des AG plus longs, conduisant à des défauts membranaires. De plus, cette synthèse induit une consommation de nutriments plus importante, et par conséquent une dissipation énergétique plus élevée, sans permettre la croissance bactérienne. Ces deux défauts conduisent à la mort bactérienne. De fait, le mutant ne parvient pas à se développer ex vivo sur tissu humain, ni sur des cellules ou dans des filtrats cellulaires et tissulaires, toutes situations où les nutriments sont limités. Ces caractéristiques expliquent la nécessité de FabT pendant l'infection. Inversement, les mutants fabT présentent un avantage de croissance marqué par rapport à la souche sauvage lorsqu’ils sont exposés aux eAGs saturés, présent par exemple, dans des espaces interstitiels. En effet, les AG saturés sont toxiques suite à leur incorporation par la souche sauvage. Les scientifiques ont montré que l’activité continue de FASII, telle que dans le mutant fabT, empêche cette incorporation. En outre, des mutants spontanés de fabT ont été obtenus in vitro lors de culture de la souche sauvage en présence d’eAGs saturés. De plus, un modèle ex vivo de muscle, qui est riche en AGs saturés, a révélé que le mutant fabT présente un avantage de croissance marquée comparé à la souche sauvage. En effet, la survie du mutant fabT, ou de SGA sauvage dépend de la localisation de la bactérie.
Ces résultats élucident la raison d'être des mutants fabT émergents qui améliorent la survie dans les biotopes riches en lipides composés d’AGs saturés, mais conduisent à une impasse génétique pour l'infection.
Ces équipes avaient préalablement démontré qu’inhiber la voie FASII n’était pas une option thérapeutique du fait de l’incorporation d’eAG in vivo par différentes espèces bactériennes à Gram positif. La présente étude indique, qu’a contrario rendre la synthèse de FASII constitutive en inhibant FabT, est préjudiciable à l'infection in vivo. FabT est donc une cible thérapeutique potentielle pour de nouvelles thérapies contre des pathogènes à Gram-positif spécifiques, y compris SGA, Streptococcus agalactiae, Streptococcus pneumoniae et Enterococcus faecalis.
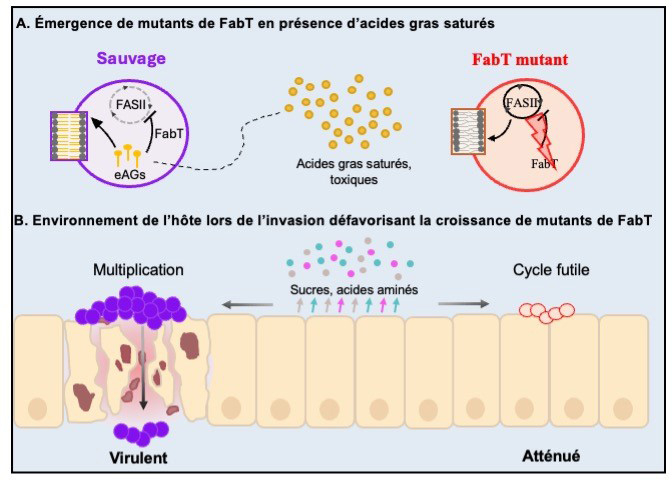
Figure : Modèle d'émergence de mutants fabT dont la virulence est atténuée.
A, les acides gras (AGs) saturés dans un environnement lipidique favorisent l'émergence de mutants de FabT. En effet, les AGs saturés, toxiques lorsqu’ils sont incorporés uniquement par la souche sauvage, peuvent être présents lors des premiers contacts du SGA avec l'hôte. La contre-sélection conduit à l'émergence de mutants fabT qui n’incorporent pas les AGs. B, L'environnement de la cellule hôte pendant l'invasion, pauvre en nutriments, entrave la croissance de mutants de FabT. La déstabilisation de la membrane par des AGs à chaîne longue, produits en continue par les mutants fabT, entraîne un métabolisme futile, ne permettent pas la croissance bactérienne. Ainsi, les mutants de FabT dans les populations de SGA peuvent conférer un avantage de survie au site d'inoculation (riche en AGs), mais ne résistent pas aux conditions d'infection de l’hôte (pauvre en nutriments). Cercles mauves et rouges, cocci sauvages et mutants de FabT ; zoom sur les phospholipides. Les petits cercles et lignes jaunes représentent respectivement les lipides et les produits d'hydrolyse des eAGs ; les petits cercles rose, bleus et gris, les sucres et les résidus d'acides aminés et les flèches de même couleur, leur sécrétion par les cellules.
Référence :
The double-edged role of FASII regulator FabT in Streptococcus pyogenes infection. Lambert C, Gaillard M, Wongdontree P, Bachmann C, Hautcoeur A, Gloux K, Guilbert T, Méhats C, Prost B, Solgadi A, Abreu S, Andrieu M, Poyart C, Gruss A* and Fouet A*.
4 octobre 2024, Nature Communication, DOI : 10.1038/s41467-024-52637-3
Laboratoire de la circonscription impliqué
Institut Cochin (CNRS/Inserm/Université Paris Cité)
22 rue Méchain
75014 Paris
